As contribuições vão até o dia 16/02 no site da ANVISA. Confira como contribuir AQUI
O ustequinumabe já apresenta aprovação na ANVISA para uso na retocolite ulcerativa (RCU) desde outubro de 2019, data posterior a submissão de nosso dossiê para incorporação de todas as terapias biológicas até então aprovadas para RCU, em maio de 2019. No entanto, na mais recente atualização do PCDT de retocolite ulcerativa no SUS, essa tecnologia não foi avaliada, o que impede qualquer espelhamento de incorporação do setor privado com o setor público para esta tecnologia especificamente.
O ustequinumabe (UST) é um anticorpo monoclonal que bloqueia a subunidade p40 da interleucina-12 e da interleucina-23. O UST está indicado para o tratamento da psoríase, da artrite psoriática e da doença de Crohn (1,2). O ustequinumabe (UST) é um anticorpo monoclonal que bloqueia a subunidade p40 da interleucina-12 e da interleucina-23. O UST está indicado para o tratamento da psoríase, da artrite psoriática e da doença de Crohn (21,28). Recentemente, a ANVISA aprovou o UST para o tratamento da RCU moderada-grave refratária à terapia convencional (3). A eficácia e segurança do UST na RCU foi comprovada em um estudo multicêntrico, randomizado e placebo controlado denominado UNIFI (21). Foram incluídos 961 pacientes para o estudo. O UST foi avaliado após a indução com a dose de 130 mg, 6 mg/Kg e placebo em pacientes com RCU moderada-grave virgens ou previamente expostos à terapia com outros agentes biológicos. Os pacientes respondedores a terapia de indução ao final de 8 semanas após a indução foram randomizados para o tratamento de manutenção para receber placebo ou UST na dose de 90 mg SC a cada 8 ou 12 semanas por um período de 44 semanas. As taxas de remissão clínica com UST após a indução (UST dose 130 mg = 15,6% e UST dose 6 mg/Kg = 15,5%) foram superiores ao placebo (5,3%). Na fase de manutenção, ao final de 44 semanas de tratamento, as taxas de remissão clínica nos pacientes que receberam o UST 90 mg SC a cada 8 semanas (43,8%) ou a cada 12 semanas (38,4%) foram superiores à dos que receberam placebo (24,0%) (1). Esses dados publicados deram subsídio à aprovação do UST para o tratamento da RCU pela ANVISA (3).
Amiot et al. (2020) avaliaram a efetividade e segurança da terapia de indução com ustequinumabe em 103 pacientes com RCU (8). O desfecho primário avaliado foi remissão clínica livre de corticoides nas semanas 12-16 (definida como escore parcial de Mayo ≤2, com uma combinação da subpontuação de frequência evacuatória e sangramento retal ≤1). O estudo demonstrou que, em uma população de pacientes refratários, em sua maioria com exposição prévia a mais de dois biológicos (69,9%), UST foi eficaz na indução de remissão clínica livre de corticoides em 1/3 dos pacientes com RCU refratária em 16 semanas de segmento, com um bom perfil de
segurança (8). Mais recentemente, Hong et al. (2021) descreveram a efetividade e a segurança do UST para RCU a longo prazo em dois centros nos Estados Unidos (9). Nesta coorte de pacientes com RCU majoritariamente refratários a biológicos, o tratamento com UST atingiu remissão em quase metade deles aos 12 meses e foi associado a um perfil de segurança favorável (9). Tais resultados são levemente melhores do que os ensaios pivotais e refletem a experiência clínica com a droga em um cenário de mundo real.
Como sociedade, nos chamou atenção a seguinte justificativa à não incorporação de UST:
Parecer: “Não foram encontrados estudos comparativos entre o USTEQUINUMABE e as três opções de tratamento para a população de interesse e que estão incluídos no rol atual da ANS). Metanálises com comparações indiretas apresentam limitações que podem impactar nos resultados e na implementação de tecnologias diante da possibilidade de que estudos futuros com comparação direta (head to head) possam modificar os achados. Por estas razões, e em comum acordo com a equipe ANS, o PARECERISTA optou por não utilizar metanálises com comparações indiretas neste RAC.
No entanto, sabe-se que, na ausência de estudos head-to-head, as revisãoes sistemáticas com metanálise constituem a melhor evidência disponível para avaliar a eficácia e a segurança de tratamentos (Figura 1), sendo frequentemente utilizadas para dar suporte às tomadas de decisões clínicas e nas políticas na saúde. Além disso, os medicamentos atualmente aprovados para retocolite ulcerativa no rol da ANS (infliximabe, golimumabe e vedolizumabe) também foram avaliados levando em consideração dados de revisões sistemáticas e metanálises.
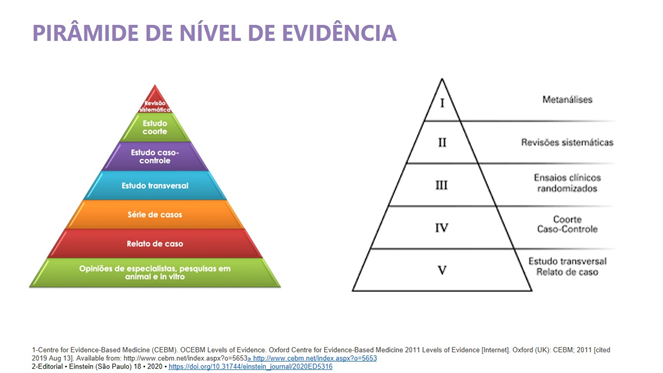
São justificativas para a incorporação do ustequinumabe para o tratamento da RCU: mecanismo de ação diferente, uso subcutâneo, perfil de segurança e possibilidade de atuação em outras comorbidades imunomediadas.
- O UST é um agente que bloqueia as interleucinas 12 e 23 e consequentemente controla o processo mediado pela via TH1 e TH17. É sabido que cerca de 30 a 50% dos pacientes são não respondedores primários a qualquer medicamento usado no tratamento das DII (4). Seria conveniente e importante termos vários mecanismos de ação distintos para indicar quando necessário, especialmente os com baixa imunogenicidade como o UST que possam ser usados em monoterapia, uma vez que não é incomum a interrupção do tratamento devido a eventos adversos. Reações alérgicas relacionadas aos anti-TNF são descritas em 5 a 8%, o que pode levar a interrupção do tratamento e consequente necessidade de substituição por outro agente. A disponibilidade de outros mecanismos de ação já é uma realidade no tratamento da artrite reumatoide e na Doença de Crohn. A não equidade relativa à RCU constitui uma evidente necessidade não atendida.
- Como vimos anteriormente nesse texto quando nos referimos ao adalimumabe e ao golimumabe, o uso subcutâneo pode ter vantagens claras em relação ao uso endovenoso. Principalmente quando ser refere à praticidade de uso domiciliar sem envolver centros de infusão. Isso de certa forma pode trazer melhor adesão à terapia. Ademais, o UST tem uma vantagem de poder ser administrado a cada 8 ou 12 semanas.
- Somada às vantagens de ser um mecanismo de ação diferente, de uso subcutâneo, e de posologia cômoda, o UST tem um perfil de segurança superior aos outros imunossupressores como os anti-TNF e o TOFA. O UST tem um perfil de segurança semelhante ao vedolizumabe (5).
- Em situações clínicas nas quais o paciente apresente contraindicação ao infliximabe, golimumabe, ou seja, anti -TNFs, o único medicamento disponível na via suplementar – ANS é o vedolizumabe. No entanto, o mesmo é seletivo ao intestino e não apresenta eficácia no controle de comorbidades imunomediadas.
- Embora representem uma importante fonte de dados sobre a eficácia e segurança de um novo tratamento, os desenhos rigorosos e seletivos dos ensaios clínicos randomizados, com múltiplos critérios de inclusão e exclusão, impedem a generalização dos achados para a prática clínica de rotina. Considerando-se que apenas aproximadamente 30% dos pacientes da “vida real” são elegíveis para estudos pivotais (6,7) estudos de efetividade no mundo real são cruciais para demonstrar o comportamento da droga na prática clínica diária.
- O controle adequado da doença sabidamente diminui as taxas de cirurgia e hospitalizações, o que, obviamente, ao longo do tempo, impactará de sobremaneira nos custos de tratamento da doença. Estudo de 2020 com ustequinumabe demonstrou estatisticamente significativa redução de hospitalização e cirurgia na semana 8 e de cirurgia na semana 44, com uma economia total de US$ 2.603,00 por paciente por ano (10).
Mediante eficácia já comprovada do ustequinumabe na RCU e a possiblidade de ser mais uma opção terapêutica disponível, o GEDIIB entende que o USTEQUINUMABE deve ser incorporado como tratamento dos pacientes com doença moderada a grave, que não apresentaram resposta aos tratamentos prévios (convencional ou terapia biológica) antes de se considerar a colectomia total. Assim, recomendamos a incorporação do ustequinumabe para uso em pacientes com doença moderada a grave e índice de atividade da doença igual ou maior a 6 pelo escore de Mayo (com subescore de endoscopia de pelo menos 2), refratários ou intolerantes ao uso de corticoides, aminossalicilatos, tiopurinas e/ou biológicos.
Referências:
- Sands BE, Sandborn WJ, Panaccione R, O’Brien CD, Zhang H, Johanns J, Adedokun OJ, Li K, Peyrin-Biroulet L, Van Assche G, Danese S, Targan S, Abreu MT, Hisamatsu T, Szapary P, Marano C; UNIFI Study Group. Ustekinumab as Induction and Maintenance Therapy for Ulcerative Colitis. N Engl J Med. 2019 Sep 26;381(13):1201-1214
- Benson JM, Peritt D, Scallon BJ, Heavner GA,1 Shealy DJ, Giles-Komar JM, Mascelli MA. Discovery and mechanism of ustekinumab. A human monoclonal antibody targeting interleukin-12 and interleukin-23 for treatment of immune-mediated disorders. MAbs. 2011 Nov-Dec; 3(6): 535–545
- https://gediib.org.br/noticias/anvisa-aprova-o-uso-do-ustequinumabe-para-retocolite-ulcerativa-rcu/ acessado 29/11/2019
- Singh S, George J, Boland BS, Vande Casteele N, Sandborn WJ.Primary Non-Response to Tumor Necrosis Factor Antagonists is Associated with Inferior Response to Second-line Biologics in Patients with Inflammatory Bowel Diseases: A Systematic Review and Meta-analysis. J Crohns Colitis. 2018 May 25;12(6):635-643
- Singh S, Fumery M, Sandborn WJ, Murad MH. Systematic review and network meta-analysis: first- and second-line biologic therapies for moderate-severe Crohn’s disease. Aliment Pharmacol Ther. 2018 Aug;48(4):394-409
- Pugliese D, Privitera G, Rogai F, Variola A, Viola A, Laterza L, et al. Two-year effectiveness and safety of golimumab in ulcerative colitis: An IG-IBD study. United Eur Gastroenterol J. 2020;
- C H, TA U, CA S, A K. Patients enrolled in randomized controlled trials do not represent the inflammatory bowel disease patient population. Clin Gastroenterol Hepatol [Internet]. 2012 Sep [cited 2021 Sep 9];10(9):1002–7. Available from: https://pubmed.ncbi.nlm.nih.gov/22343692/
- A A, J F, V A, G C, D L, M S, et al. Effectiveness and safety of ustekinumab induction therapy for 103 patients with ulcerative colitis: a GETAID multicentre real-world cohort study. Aliment Pharmacol Ther [Internet]. 2020 Jun 1 [cited 2021 Sep 9];51(11):1039–46. Available from: https://pubmed.ncbi.nlm.nih.gov/32291786/
- Hong SJ, Krugliak Cleveland N, Akiyama S, Zullow S, Yi Y, Shaffer SR, et al. Real-World Effectiveness and Safety of Ustekinumab for Ulcerative Colitis From 2 Tertiary IBD Centers in the United States. Crohn’s Colitis 360 [Internet]. 2021 Jan 1 [cited 2021 Sep 9];3(1):1–8. Available from: https://academic.oup.com/crohnscolitis360/article/3/1/otab002/6129461
- Ding et al. P1677. Pôster apresentado no ACG 2020.
Para baixar o parecer em formato PDF, clique aqui
Comments are closed.
 +55 11 9.4580-5406
+55 11 9.4580-5406
